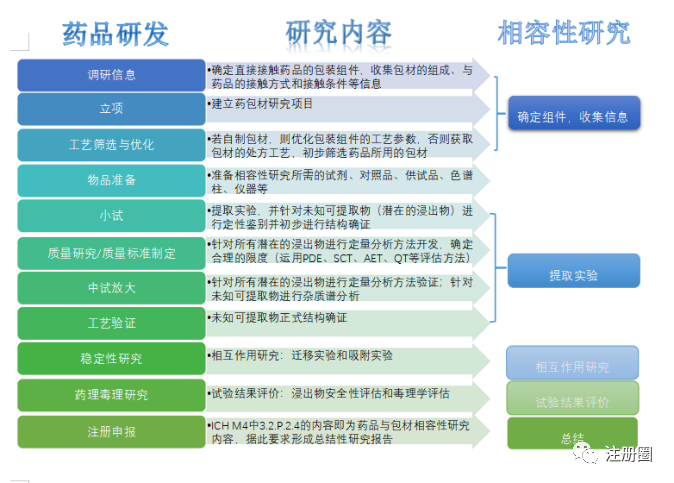
图1 药品研发流程与包材相容性研究流程的联系
表1 各国关于包材相容性研究法规汇总
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2013 |
USP<1660> Evaluation Of The Inner Surface Durability Of Glass Containers |
玻璃分类和加工工艺、影响玻璃内表面耐受性的因素、玻璃内表面耐受性评估方法(也就是预测玻璃脱片的模拟实验方法) |
|
2016 |
USP<1661>Evaluation Of Plastic Packaging Systems For Pharmaceutical Use And Their Materials Of Construction |
塑料包材的总体评估过程,包括可提取物和浸出物的作用 |
|
|
2015 |
USP<1663>Assessment Of Extractables Associated With Pharmaceutical Packaging/Delivery Systems |
详细描述了提取试验的设计思路,包括提取介质、提取时间、提取温度、提取方式和可提取物的分析方法 |
|
|
2015 |
USP<1664>Assessment Of Drug Product Leachables Associated With Pharmaceutical Packaging/Delivery Systems |
浸出物评估的概念、试验方法、浸出物分析方法、可提取物-浸出物相关性确立、浸出物的可接受标准确定 |
|
|
2020 |
USP<1664.1>Orally Inhaled And Nasal Drug Products |
针对USP<1664>中内容的补充,特别针对口鼻吸入制剂的,除USP<1664>的内容外,还提到了口鼻吸入制剂的浸出物试验条件、制剂类型、主要关注的浸出物 |
|
|
2020 |
USP<1381> Assessment Of Elastomeric Components Used In Injectable Pharmaceutical Product Packaging/Delivery Systems |
弹性体密封件概念、种类、生产工艺和主要关注的浸出物 |
|
|
2017 |
USP <381> Elastomeric Components In Injectable Pharmaceutical Product Packaging/Delivery Systems |
提到了针对弹性体密封件提取试验的条件、介质和方式 |
|
|
EMEA |
2005 |
Guideline On Plastic Immediate Packaging Materials |
提取研究的原则、相互作用研究的原则、是否需要毒理学数据 |
|
EDQM |
2019 |
EP 3.2.1.Glass Containers For Pharmaceutical Use/ |
药用玻璃的类型、制备工艺、详细描述了内表面耐受性的试验方法(与USP<1660>不同) |
|
2008 |
EP 3.2.2.1.Plastic Containers For Aqueous Solutions For Infusion |
提到了针对塑料包材提取试验的条件、介质和方式 |
|
|
2018 |
EP 3.2.9.Rubber Closures For Containers For Aqueous Parenteral Preparations, For Powders And For Freeze-Dried Powders |
提到了针对橡胶密封件提取试验的条件、介质和方式 |
|
|
2008 |
EP 3.1.9.Silicone Elastomer For Closures And Tubing |
提到了针对硅胶密封件提取试验的条件、介质和方式 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
由表1可知,欧美在药物与包材相容性研究方面起步较早,美国FDA早在1999年发布的《Container Closure Systems for Packaging Human Drugs and Biologics》中就提出了药物与包材相容性的概念,这也是最早提出此概念的法规,并根据不同给药途径制剂与包装系统发生相互作用的可能性建立了风险分级表(见表2),此表后来也被其他国家的法规(包括我国NMPA发布的三项指导原则)陆续引用,一直沿用至今,具有深远的影响;欧盟EMEA也在2005年发布了《Guideline On Plastic Immediate Packaging Materials》,并深入地描述了相容性的研究内容—提取研究和相互作用研究的原则;我国在药物与包材相容性研究方面起步较晚,直到2012年才由原SFDA(现NMPA)发布了第一项关于包材相容性的指导原则—《化学药品注射剂与塑料包装材料相容性研究技术的指导原则(试行)》,但是随着研究水平飞速增长和监管力度的不断加强,后来的CFDA(现NMPA)分别在2015年和2018年发布了针对玻璃容器和弹性体密封件相容性的指导原则,并在2015年修订了《直接接触药品包装材料和容器标准》,增加了“药品包装材料与药物相容性试验指导原则”,这些法规的发布有效地帮助国内研究者们明确了方向,开通了思路。

对比我国和欧美的法规内容可得出结论:我国NMPA发布的三项指导原则《化学药品注射剂与塑料包装材料相容性研究技术的指导原则( 试行) 》、《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》和《化学药品与弹性体密封件相容性研究技术指导原则(试行)》均详细完整地描述了药物与包材相容性的研究意义、研究思路、研究内容和试验方法,综合性和系统性较强;而FDA和EMEA发布的法规只是提到了相容性的概念和研究要求,并未提到具体可行的研究方法,研究方法均需要从USP和EP中寻找,USP和EP对塑料、玻璃、弹性体密封件等各类包材的试验方法均做了详细的描述,USP甚至单独用一部通则详细介绍可提取物研究和浸出物研究,优点是内容充实,但是分布的章节较多,比较零散,给阅读者整理带来较大的不便,因此小编建议优先参考NMPA发布的指导原则,对于指导原则中未提及的方法再去根据包材类型定向查阅USP和EP的通则,让两者实现优势互补,更高效地为我们从事研究服务!












